- Farmakogenomika přizpůsobuje léky a dávky genetickému profilu za účelem zlepšení účinnosti a bezpečnosti.
- Geny metabolismu (CYP), cíle a transportéry určují fenotyp a reakci.
- Testy (panely/WES), klinické pokyny a elektronické zdravotní záznamy s upozorněními umožňují využít výsledky v praxi.
- Klíčovými příklady jsou klopidogrel–CYP2C19, DPYD–fluoropyrimidiny a SLCO1B1–simvastatin.
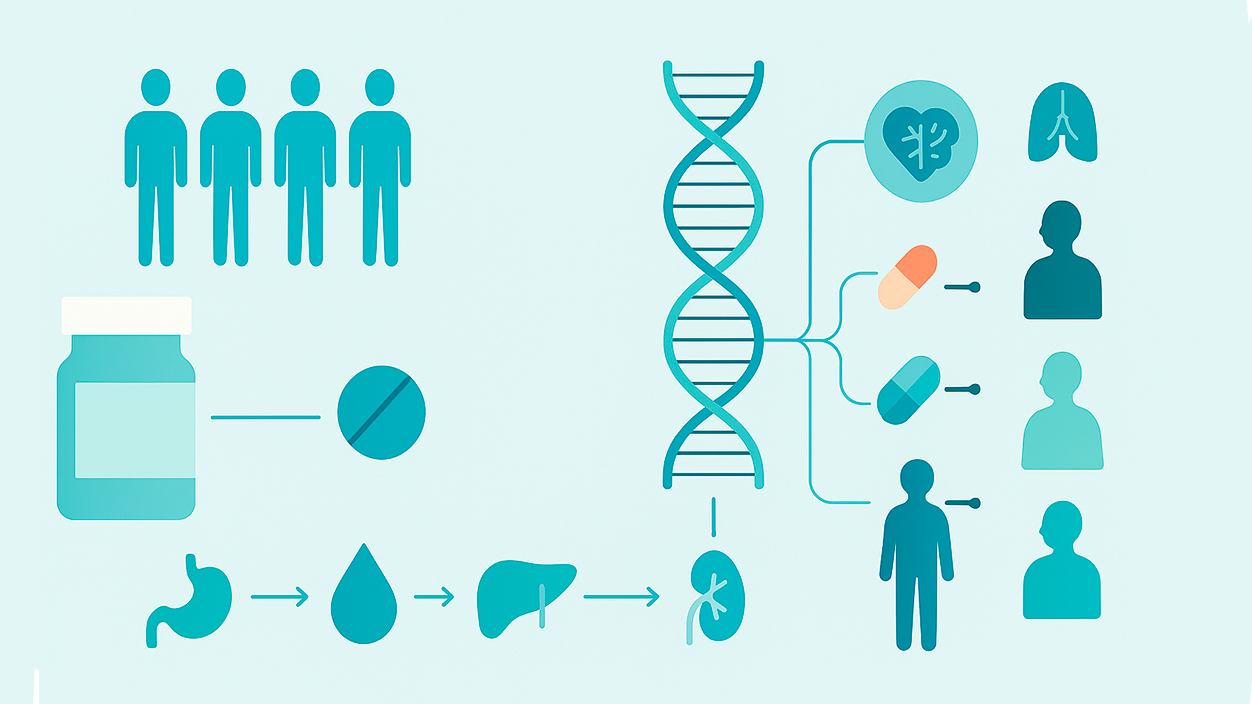
V posledních letech se medicína posunula od univerzálního přístupu k rozhodně personalizovanému a farmakogenomika je jedním z důvodů. Tato disciplína studuje Jak naše genetické varianty ovlivňují reakci na léky, s cílem předepsat správný lék, ve správné dávce a ve správný čas.
Tato změna paradigmatu nám umožňuje opustit metodu pokusů a omylů při předepisování a snížit nežádoucí účinky. Není to žádný malý výkon: Nežádoucí účinky léků jsou problémem veřejného zdraví a významnou příčinou hospitalizací a úmrtí. Farmakogenomika nabízí nástroje k predikci účinnosti a bezpečnosti léčby před jejím zahájením.
Co je farmakogenomika a proč je důležitá?

Farmakogenomika kombinuje farmacología (studie léků) a genómica (studium genů a jejich funkcí) s cílem pochopit, jak určité varianty DNA a jejich exprese ovlivňují reakci na léčbu. To umožňuje jemné doladění léky a dávky na základě genetického profilu de cada paciente.
V praxi to znamená přechod od univerzálního přístupu k přesnému přístupu. Mnoho léků nefunguje u každého stejně. a některé mohou u nositelů specifických variant způsobit závažné toxicity. Díky genetickým informacím mohou lékaři snížit rizika a zlepšit výsledky.
Od univerzálního léku k personalizované medicíně

Moderní medicína se snaží najít „správný lék, ve správné dávce, ve správný čas“. Abychom toho dosáhli, musíme vzít v úvahu obrovskou interindividuální variabilitu. Reakce na léky závisí na genetických, epigenetických a environmentálních faktorech.a příspěvek každého z nich se liší v závislosti na léku.
Paradigmatickým příkladem je warfarin: jeho optimální dávka je podmíněna geneticky (CYP2C9, VKORC1) a negenetickými proměnnými, jako je věk, pohlaví, hmotnost, kouření nebo interakce. Integrace všech těchto parametrů Zlepšuje predikci dávky a snižuje nežádoucí účinky.
Hoy sabemos que Více než 90 % populace nese alespoň jednu potenciálně účinnou farmakogenetickou variantu.a existují stovky léků s farmakogenomickými aspekty uznanými regulačními orgány. To posiluje klinickou užitečnost začlenění genetiky do preskripce.
S ohledem na budoucnost bude farmakogenomika klíčová pro personalizaci terapií v oblastech, jako je kardiologie, onkologie, neurologie nebo pneumologiea urychlit vývoj nových, bezpečnějších a účinnějších léků.
Geny, biomarkery a dráhy, které určují reakci

Genetická variabilita se obvykle měří biomarcadores jako jednonukleotidové polymorfismy (SNP). Tyto varianty mohou měnit metabolické enzymy, receptory nebo transportéry, a tím změnit účinnost nebo bezpečnost léku.
V metabolismu (fáze I) rodina enzymů CYP450 rozkládá velké množství léků. Jeho nomenklatura je založena na rodině, podrodině a enzymu (např. CYP2E1) a alelické varianty jsou anotovány pomocí systému „hvězdičky“ (*1, *2, *3…). Změny v těchto genech generují metabolizující fenotypy které určují plazmatické hladiny a klinickou odpověď.
Ve fázi II vynikají glutathion-S-transferázy, N-acetyltransferázy. UGT, sulfotransferázy a methyltransferázy, jako například TPMT nebo COMT. Varianty těchto enzymů jsou spojeny se specifickými toxicity. Pokud je eliminace zpomalena geneticky, je nutné zvolit lék s úzkým terapeutickým rozmezím. může dosáhnout nebezpečných koncentrací.
Důležité jsou i cíle léků: polymorfismy v genech, které kódují receptores změnit jejich funkci nebo projev a změnit citlivost nebo riziko nežádoucích účinků. Podobně Transportéry ABC jako P-gp (ABCB1/MDR1) modifikují absorpci, distribuci a eliminaci, což ovlivňuje expozici tkáním a jejich reakci.
Stručně řečeno, reakce na léky se vysvětluje interakcí mezi farmakokinetika (ADME) y farmacodinámica, a to jak modulované genetikou pacienta, tak v onkologii někdy i samotným genomem nádoru.
Fenotypy metabolismu: od ultrarychlého po pomalý

V závislosti na agregované enzymové aktivitě lze jedince klasifikovat jako ultrarychlý, rychlý, normální, středně rychlý nebo pomalý metabolizátorToto označení samo o sobě není „dobré nebo špatné“: jeho relevance závisí na léčivu a na tom, zda je aktivní či nikoliv. proléčivo.
Pokud je člověk pomalým metabolizátorem metabolické dráhy, která inaktivuje lék, může se u něj hromadit vysoká hladina a projevit se... toxicidadNaopak, pokud stejná metabolická dráha aktivuje proléčivo, pomalý metabolizátor bude mít méně účinné látky a terapeutické selháníProto klinické směrnice upravují doporučení na základě léku a fenotypu.
- UltrarrápidoVelmi rychle přeměňuje nebo eliminuje léčivo; v případě ztráty účinnosti může vyžadovat vyšší nebo alternativní dávky.
- Středně těžký/pomalýzvýšená expozice účinným lékům; riziko nežádoucích účinků a nutnost snížit dávky nebo se léku vyhnout.
- Normálníočekávaná aktivita enzymů; obvykle se dodržují standardní dávky, monitorují se negenetické faktory.
Kromě DNA je konečná odpověď modulována také věk, pohlaví, hmotnost, strava, komorbidity a polyfarmacie, které mohou indukovat nebo inhibovat metabolické dráhy a měnit koncentrace léčiv.
Jak provádíme výzkum: kandidátní geny, GWAS a panely
Existují dvě klasické strategie pro objevování asociací mezi geny a léčivy. První je studie kandidátních genů, zaměřený na metabolismus, transport nebo cílové geny, ekonomičtější a přímočařejší pro ověření vztahů genotyp-fenotyp.
Druhý, ten GWAS (celogenomotické asociační studie) porovnávají genetické profily mezi skupinami (případy a kontrolami) a identifikují varianty spojené s odpovědí, účinností nebo toxicitou. S poklesem nákladů na sekvenování, Tyto studie přinesly zjištění v mnoha terapeutických oblastech.
V klinické laboratoři je technickým ideálem sekvenování celého genomu (WGS), ale kvůli nákladům se v současnosti používá především exom (WES) a cílené panely. Optimální panel zahrnuje farmakokinetické a farmakodynamické markery, varianty s funkčními důkazy a užitečnou populační frekvencí pro běžně užívané léky.
Pro standardizaci praxe existují průvodci a znalostní báze, které shromažďují evidencia clínica a doporučení dávkování nebo výběr alternativ na základě genotypu. Tyto pokyny usnadňují převod výsledků testů do praktických terapeutických rozhodnutí.
Klinické příklady, kde genetika hraje roli
Některé scénáře jsou pevně dané. Například clopidogrel Jedná se o proléčivo, jehož bioaktivace závisí na CYP2C19. Varianty se ztrátou funkce jsou spojovány s nižší tvorba aktivního metabolitu a více terapeutických selhání; v těchto případech se doporučuje přejít na jiný antiagregační přípravek.
Ten/Ta/To fluorpyrimidiny (5-FU, kapecitabin) jsou ovlivněny variantami v DPYDSnížená aktivita enzymů zvyšuje riziko závažné toxicity, a proto mnoho doporučení navrhuje úpravy dávky nebo alternativy u nositelů rizikových alel.
U opioidů může variabilita v drahách CYP ovlivnit tvorbu aktivních metabolitů a zvýšit riziko depresión respiratoria Pokud je metabolismus neobvykle vysoký nebo nízký v závislosti na léku. To ilustruje, jak metabolizující fenotyp mění poměr přínosu a rizika.
Dalším případem je myopatie s simvastatinaVarianty v jaterních transportérech (např. SLCO1B1) snižují vychytávání a zvyšují jeho plazmatickou koncentraci, což bylo spojováno s daño muscular a vyžaduje opatrnost při výběru nebo dávkování.
Souvislosti mezi určitými HLA a reacciones cutáneas graves jako je Stevens-Johnsonův syndrom nebo toxická epidermální nekrolýza, a predispozice k hipertermia maligna s anestetiky ve specifických genetických kontextech.
Farmakogenomické testování: co analyzuje a jak se provádí

Test lze provést ze slin, výtěru z úst nebo krve. Laboratoř extrahuje DNA a analyzuje varianty, které ovlivňují léky zahrnuté v klinických pokynech. Výsledky se po celý život nemění (váš genotyp zůstává), ačkoli interpretace se aktualizují s vývojem důkazů.
V klinické praxi zprávy uvádějí geny, genotypy, fenotypy (např. středně pokročilý metabolizátor) a doporučení: upravit dávku, zvolit alternativu nebo pokračovat v léčbě za současného sledování. Je nezbytné, aby se úpravy léčby vždy provedly zdravotnický pracovník.
Některé laboratoře nabízejí komplexní panely pro pacienty podstupující polyfarmágii. Tento preventivní přístup umožňuje vyhněte se rizikovým receptům od začátku léčby, spíše než reagovat po nežádoucí příhodě.
Omezení a výzvy, které stále musíme překonat
Přetrvávají překážky: nedostatek nákladově efektivních laboratoří, estándares de calidad dobře definované právní/etické směrnice a záruky, stejně jako nedostatek odborníků vyškolených k interpretaci výsledků.
Dalším častým omezením je doba odezvy: pokud se testy provedou po nežádoucí události, ztrácejí část své preventivní hodnoty. Proto je tu tlak na… preventivní modely (preventivní genotypizace) integrovaná do klinické anamnézy a systémů podpory rozhodování.
Objemy dat představují také výzvu: bezpečná integrace, interpretace a ukládání genomických informací bajo coste vyžaduje investice do infrastruktury a správy dat.
Konečně je potřeba víc formación clínica a snadno použitelné nástroje. Důkazy se rychle hromadí, ale jejich přeměna na jasná klinická rozhodnutí je klíčovým krokem k tomu, aby se farmakogenomika stala rutinní praxí.
Farmakogenomika vs. farmakogenetika: není to totéž.
La farmacogenética označuje, jak variace ve specifických genech ovlivňují metabolismus a reakci na lék. farmacogenómica Rozšiřuje zaměření na celý genom a kromě změn v DNA zahrnuje i aspekty expresión génica které modulují farmakologickou odpověď.
V literatuře se oba termíny po léta používaly zaměnitelně, ale vzestup genomiky upevnil přesnější rozlišeníFarmakogenetika je součástí farmakogenomiky, nikoli jejím synonymem.
Kdy požádat o farmakogenomický test
Je to obzvláště užitečné před zahájením užívání léků alto riesgo de toxicidad spojené se známými variantami (např. thiopuriny a TPMT/NUDT15; fluoropyrimidiny a DPYD; karbamazepin a HLA) v terapeutické selhání nevysvětlitelná nebo pokud je plánována polyfarmace.
Je to také vhodné u pacientů, u kterých se v průběhu času očekává expozice více lékům: Genetický výsledek je platný po celý život a lze jej nahlédnout při každém předepsání léku..
Aby se maximalizovala jejich hodnota, musí být výsledky integrovány do historia clínica electrónica s upozorněními a rozhodovacími pravidlya doprovázeno školením zdravotnického týmu.
Farmakogenomika, dobře implementovaná, působí jako další vrstva zabezpečení, která přispívá ke klinickému úsudku, klasická farmakologie a preference pacienta k určení nejlepší terapeutické možnosti.
Důkazy a technologie se rychle rozvíjejí a s nimi i možnost, aby každý člověk dostal léčbu lépe přizpůsobenou jeho biologii. Díky vyškoleným týmům, jasným pokynům a integrovaným datům… přesný předpis již nebude výjimkou aby se stala běžnou praxí.
Jsem technologický nadšenec, který ze svých „geekovských“ zájmů udělal profesi. Strávil jsem více než 10 let svého života používáním nejmodernějších technologií a vrtáním se všemi druhy programů z čisté zvědavosti. Nyní se specializuji na počítačovou techniku a videohry. Je to proto, že již více než 5 let píšu pro různé webové stránky o technologiích a videohrách a tvořím články, které se vám snaží poskytnout informace, které potřebujete, v jazyce, který je srozumitelný všem.
Pokud máte nějaké dotazy, mé znalosti sahají od všeho, co se týká operačního systému Windows a také Androidu pro mobilní telefony. A můj závazek je vůči vám, jsem vždy ochoten strávit pár minut a pomoci vám vyřešit jakékoli otázky, které můžete mít v tomto internetovém světě.