- Farmakogenomiikka mukauttaa lääkkeitä ja annoksia geneettiseen profiiliin tehon ja turvallisuuden parantamiseksi.
- Aineenvaihduntageenit (CYP), kohteet ja kuljettajat määräävät fenotyypin ja vasteen.
- Testit (paneelit/WES), kliiniset ohjeet ja hälytyksillä varustetut sähköiset potilaskertomukset tekevät tuloksista hyödynnettäviä.
- Klopidogreeli–CYP2C19, DPYD–fluoropyrimidiinit ja SLCO1B1–simvastatiini ovat keskeisiä esimerkkejä.
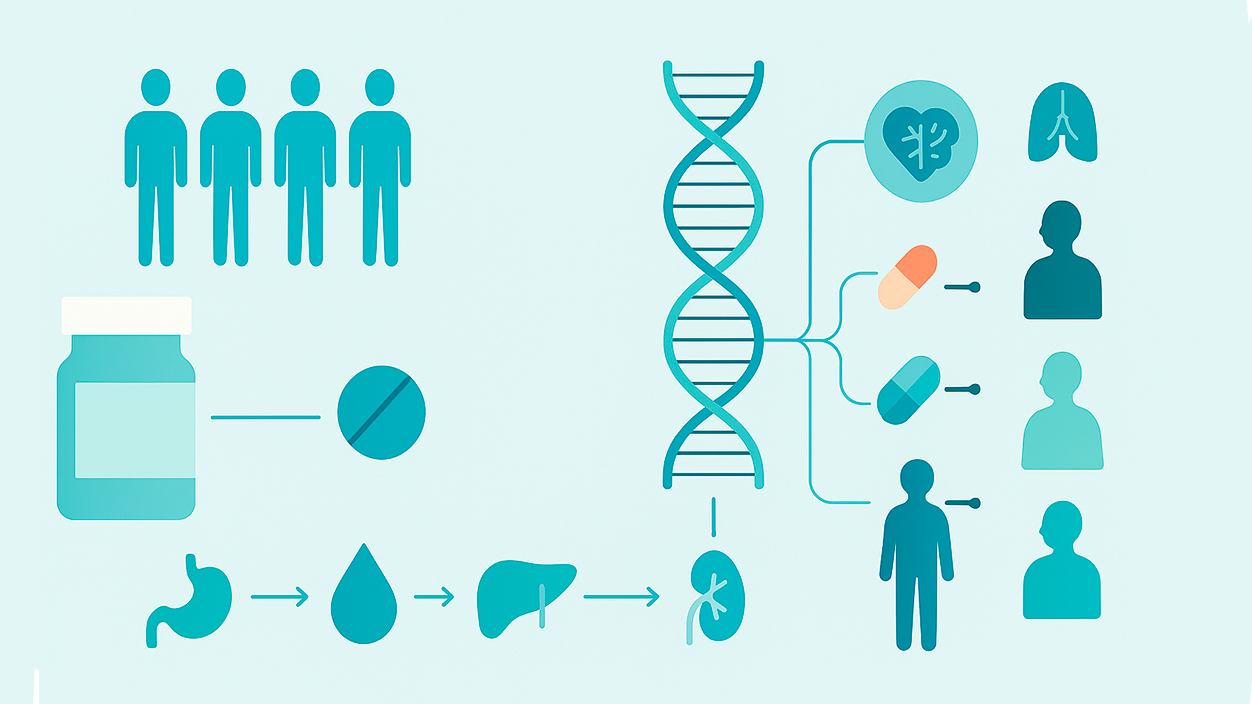
Viime vuosina lääketiede on siirtynyt yhden koon kaikille -lähestymistavasta ehdottomasti yksilöllisempään lähestymistapaan, ja farmakogenomiikka on yksi syy tähän. Tämä tieteenala tutkii Miten geneettiset varianttimme vaikuttavat lääkkeiden tehoon, tavoitteena oikean lääkkeen määrääminen oikealla annoksella ja oikeaan aikaan.
Tämä paradigman muutos antaa meille mahdollisuuden luopua yrityksen ja erehdyksen menetelmästä lääkkeiden määräämisessä ja vähentää haittavaikutuksia. Se ei ole mikään pieni saavutus: Lääkkeiden haittavaikutukset ovat kansanterveysongelma ja merkittävä sairaalahoitojen ja kuolleisuuden syy. Farmakogenomiikka tarjoaa työkaluja hoidon tehokkuuden ja turvallisuuden ennustamiseen ennen sen aloittamista.
Mitä on farmakogenomiikka ja miksi sillä on merkitystä?

Farmakogenomiikka yhdistää farmakologia (huumeiden tutkimus) ja genomiikka (geenien ja niiden toiminnan tutkimus) ymmärtääkseen, miten tietyt DNA-variantit ja niiden ilmentyminen muokkaavat hoitovastetta. Tämä mahdollistaa hienosäädön geneettiseen profiiliin perustuvat lääkkeet ja annokset jokaisesta potilaasta.
Käytännössä tämä tarkoittaa siirtymistä "yksi koko sopii kaikille" -lähestymistavasta täsmälähestymistapaan. Monet lääkkeet eivät tehoa samalla tavalla kaikille. ja jotkut voivat aiheuttaa vakavia myrkytyksiä tietyille varianteille. Geneettisen tiedon avulla lääkärit voivat vähentää riskejä ja parantaa tuloksia.
Yhden koon lääketieteestä personoituun lääketieteeseen

Nykyaikainen lääketiede pyrkii "oikeaan lääkkeeseen, oikealla annoksella, oikeaan aikaan". Tämän saavuttamiseksi meidän on otettava huomioon valtava yksilöiden välinen vaihtelu. Lääkkeiden vaste riippuu geneettisistä, epigeneettisistä ja ympäristötekijöistä, ja kunkin vaikutus vaihtelee lääkkeestä riippuen.
Paradigmaattinen esimerkki on varfariini: sen optimaalinen annos määräytyy genetiikan mukaan (CYP2C9, VKORC1) ja ei-geneettisten muuttujien, kuten iän, sukupuolen, painon, tupakoinnin tai vuorovaikutusten, perusteella. Kaikkien näiden parametrien integrointi Parantaa annoksen ennustamista ja vähentää haittavaikutuksia.
Nykyään tiedämme, että Yli 90 % väestöstä kantaa ainakin yhtä potentiaalisesti vaikuttavaa farmakogeneettistä varianttia, ja on olemassa satoja lääkkeitä, joilla on farmakogenomiset näkökohdat, jotka ovat sääntelyviranomaisten tunnustamia. Tämä vahvistaa genetiikan sisällyttämisen kliinistä hyödyllisyyttä lääkkeiden määräämisessä.
Tulevaisuudessa farmakogenomiikka on avainasemassa hoitojen personoinnissa esimerkiksi seuraavilla aloilla: kardiologia, onkologia, neurologia tai pulmonologiaja nopeuttaa uusien, turvallisempien ja tehokkaampien lääkkeiden kehittämistä.
Geenit, biomarkkerit ja vasteen määräävät reitit

Geneettistä vaihtelua mitataan yleensä biomarkkerit kuten yksittäisiä nukleotidipolymorfismeja (SNP). Nämä variantit voivat muuttaa metaboloivia entsyymejä, reseptoreita tai kuljettajia ja siten muuttaa tehoa tai turvallisuutta huumeesta.
Aineenvaihdunnassa (vaihe I) entsyymien perhe CYP450 hajottaa suuren määrän lääkkeitä. Sen nimikkeistö perustuu perheeseen, alaryhmään ja entsyymiin (esim. CYP2E1), ja alleelivariantit on merkitty "tähti"-järjestelmällä (*1, *2, *3…). Näiden geenien muutokset synnyttävät metaboloivat fenotyypit jotka määrittävät plasmapitoisuudet ja kliinisen vasteen.
Vaiheessa II erottuvat glutationi-S-transferaasit, N-asetyylitransferaasit. UGT, sulfotransferaasit ja metyylitransferaasit, kuten TPMT tai COMT. Näiden entsyymien variantit liittyvät tiettyihin toksisuuksiin. Jos eliminaatio hidastuu genetiikan vuoksi, voidaan käyttää lääkettä, jolla on kapea terapeuttinen alue voi saavuttaa vaarallisia pitoisuuksia.
Myös lääkekohteilla on merkitystä: geenien polymorfismit, jotka koodaavat reseptorit muuttaa niiden toimintaa tai ilmentymistä ja muuttaa herkkyyttä tai haittavaikutusten riskiä. Samoin ABC-kuljetusautot kuten P-gp (ABCB1/MDR1), muuttavat imeytymistä, jakautumista ja eliminaatiota, mikä vaikuttaa kudosaltistukseen ja -vasteeseen.
Lyhyesti sanottuna vaste lääkkeille selittyy vuorovaikutuksella farmakokinetiikka (ADME) y farmakodynamiikka, joita sekä potilaan genetiikka että joskus onkologiassa itse kasvaimen genomi säätelevät.
Aineenvaihdunnan fenotyypit: ultranopeasta hitaaseen

Entsyymien kokonaisaktiivisuudesta riippuen henkilö voidaan luokitella seuraavasti: ultranopea, nopea, normaali, keskivahva tai hidas metaboloijaTämä merkintä ei sinänsä ole "hyvä tai huono": sen merkitys riippuu lääkkeestä ja siitä, onko se vaikuttava vai ei. aihiolääke.
Jos henkilö metaboloi hitaasti lääkettä inaktivoivaa reittiä, hänelle voi kertyä korkeita pitoisuuksia ja esiintyä myrkyllisyysPäinvastoin, jos sama reitti aktivoi aihiolääkkeen, hitaasti metaboloivalla on vähemmän vaikuttavaa ainetta ja terapeuttinen epäonnistuminenSiksi kliiniset ohjeet mukauttavat suosituksia lääkkeen ja fenotyypin perusteella.
- Ultranopeamuuntaa tai poistaa lääkkeen hyvin nopeasti; voi vaatia suurempia tai vaihtoehtoisia annoksia, jos teho heikkenee.
- Keskitaso/hidaslisääntynyt altistuminen vaikuttaville lääkkeille; haittavaikutusten riski ja tarve pienentää annoksia tai välttää lääkettä.
- Normaaliodotettu entsyymiaktiivisuus; yleensä noudatetaan standardiannoksia ja seurataan ei-geneettisiä tekijöitä.
DNA:n lisäksi lopullista vastetta säätelevät ikä, sukupuoli, paino, ruokavalio, liitännäissairaudet ja monilääkitys, jotka voivat indusoida tai estää aineenvaihduntareittejä ja muuttaa lääkepitoisuuksia.
Tutkimusmenetelmämme: kandidaattigeenit, GWAS-analyysit ja paneelit
Geeni-lääke-yhteyksien löytämiseen on kaksi klassista strategiaa. Ensimmäinen on ehdokasgeenitutkimukset, keskittyen aineenvaihduntaan, kuljetukseen tai kohdegeeneihin, on taloudellisempaa ja suorempaa validoida genotyyppi-fenotyyppisuhteita.
Toinen, GWAS (koko genomin kattavat assosiaatiotutkimukset) vertailevat geneettisiä profiileja ryhmien (tapaukset ja kontrollit) välillä ja tunnistavat vasteeseen, tehoon tai toksisuuteen liittyviä variantteja. Sekvensointikustannusten laskiessa Nämä tutkimukset ovat johtaneet havaintoihin useilla terapeuttisilla alueilla.
Kliinisessä laboratoriossa koko genomin sekvensointi (WGS) on tekninen ihannetapaus, mutta kustannusten vuoksi sitä käytetään tällä hetkellä pääasiassa eksomi (WES) ja kohdennettuja paneeleja. Optimaalinen paneeli sisältää farmakokineettiset ja farmakodynaamiset markkerit, variantit, joilla on toiminnallista näyttöä ja hyödyllinen populaatiofrekvenssi yleisesti käytetyille lääkkeille.
Käytännön standardoimiseksi on olemassa oppaita ja tietokantoja, jotka keräävät tietoa kliininen näyttö ja annostussuosituksia tai vaihtoehtojen valintaa genotyypin perusteella. Näiden oppaiden avulla testitulosten muuttaminen toimintakelpoisiksi hoitopäätöksiksi on helpompaa.
Kliinisiä esimerkkejä, joissa genetiikalla on merkitystä
Jotkin skenaariot ovat vakiintuneita. Esimerkiksi klopidogreeli Se on aihiolääke, jonka bioaktivaatio on riippuvainen CYP2C19:stä. Toimintahäviövariantit liittyvät aktiivisen metaboliitin pienempi muodostuminen ja enemmän hoitovirheitä; näissä tapauksissa on suositeltavaa vaihtaa toiseen verihiutaleiden aggregaatiota estävään aineeseen.
The fluoropyrimidiinit (5-FU, kapesitabiini) ovat metabolisten tekijöiden vaikutuksen alaisia. DPYDEntsyymiaktiivisuuden heikkeneminen lisää vakavan toksisuuden riskiä, minkä vuoksi monissa ohjeissa ehdotetaan annosmuutokset tai vaihtoehdot riskialleelien kantajilla.
Opioidien kanssa CYP-reittien vaihtelu voi muuttaa aktiivisten metaboliittien muodostumista ja lisätä riskiä hengityslama Jos metabolia on epätavallisen korkea tai matala lääkkeestä riippuen. Tämä havainnollistaa, miten metaboloiva fenotyyppi muuttaa hyöty-riskisuhdetta.
Toinen tapaus on myopatia, johon liittyy simvastatiiniMaksan kuljettajaproteiinien variantit (esim. SLCO1B1) vähentävät ottoa ja lisäävät sen pitoisuutta plasmassa, mikä on yhdistetty lihasvaurio ja vaatii varovaisuutta valinnassa tai annostuksessa.
Tiettyjen HLA-antigeenien väliset yhteydet ja vakavat ihoreaktiot kuten Stevens-Johnsonin oireyhtymä tai toksinen epidermaalinen nekrolyysi, ja alttius pahanlaatuinen hypertermia anestesia-aineiden kanssa tietyissä geneettisissä yhteyksissä.
Farmakogenominen testaus: mitä se analysoi ja miten se suoritetaan

Testi voidaan tehdä syljestä, suusta otetusta näytteestä tai verestä. Laboratorio eristää DNA:ta ja analysoi variantteja, jotka vaikuttavat kliinisten ohjeiden piiriin kuuluviin lääkkeisiin. Tulokset eivät muutu läpi elämän (genotyyppisi säilyy), vaikka tulkintoja päivitetään todisteiden kehittyessä.
Kliinisessä käytännössä raportit osoittavat geenejä, genotyyppejä, fenotyyppejä (esim. keskipitkä metaboloija) ja suositukset: säädä annosta, valitse vaihtoehto tai jatka lääkkeen käyttöä seurannassa. On erittäin tärkeää, että hoitomuutokset tehdään aina terveydenhuollon ammattilainen.
Jotkut laboratoriot tarjoavat kattavia paneeleja potilaille, jotka saavat monilääkitystä. Tämä ennaltaehkäisevä lähestymistapa mahdollistaa välttää riskialttiita reseptejä hoidon alusta alkaen sen sijaan, että reagoitaisiin haittavaikutuksen jälkeen.
Rajoitukset ja haasteet, jotka meidän on vielä voitettava
Esteitä on edelleen: kustannustehokkaiden laboratorioiden puute, laatustandardit selkeästi määritellyt oikeudelliset/eettiset ohjeet ja takuut sekä tulosten tulkitsemiseen koulutettujen ammattilaisten puute.
Toinen yleinen rajoitus on vasteaika: jos testit suoritetaan haittatapahtuman jälkeen, ne menettävät osan ennaltaehkäisevästä arvostaan. Siksi tarvitaan ennaltaehkäisevät mallit (ennaltaehkäisevä genotyypitys) integroituna kliiniseen historiaan ja päätöksentukijärjestelmiin.
Myös datamäärät ovat haaste: genomitietojen integrointi, tulkinta ja tallentaminen turvallisesti ja edullinen vaatii investointeja infrastruktuuriin ja tiedonhallintaan.
Lopulta tarvitaan lisää kliininen koulutus ja helppokäyttöisiä työkaluja. Todisteet kertyvät nopeasti, mutta niiden muuttaminen selkeiksi kliinisiksi päätöksiksi on ratkaiseva askel kohti farmakogenomiikan rutiininomaistamista.
Farmakogenomiikka vs. farmakogenetiikka: ne eivät ole sama asia.
La farmakogenetiikka viittaa siihen, miten tiettyjen geenien vaihtelut vaikuttavat aineenvaihduntaan ja lääkevasteeseen. farmakogenomiikka Se laajentaa tarkastelua koko genomiin ja sisältää DNA:n muutosten lisäksi näkökohtia geenien ilmentyminen jotka moduloivat farmakologista vastetta.
Kirjallisuudessa molempia termejä käytettiin vuosien ajan synonyymeinä, mutta genomiikan nousu on vakiinnuttanut asemansa. tarkempi erotteluFarmakogenetiikka on osa farmakogenomiikkaa, ei sen synonyymi.
Milloin farmakogenomista testiä kannattaa pyytää
Se on erityisen hyödyllinen ennen lääkkeiden aloittamista suuri myrkyllisyysriski liittyy tunnettuihin variantteihin (esim. tiopuriinit ja TPMT/NUDT15; fluoropyrimidiinit ja DPYD; karbamatsepiini ja HLA) terapeuttiset epäonnistumiset selittämätöntä tai kun suunnitellaan monilääkitystä.
Se on myös järkevää potilailla, joilla odotetaan olevan useita lääkealtistuksia ajan kuluessa: Geneettinen tulos on voimassa koko elämän ajan, ja sitä voi tarkastella aina reseptiä kirjoitettaessa..
Jotta niiden arvo olisi mahdollisimman suuri, tulokset on integroitava sähköinen terveyskertomus hälytyksillä ja päätössäännöilläja siihen liittyy terveydenhuoltotiimin koulutus.
Farmakogenomiikka, hyvin toteutettu, toimii lisäturvakerroksena, joka lisää kliinistä harkintaa, klassinen farmakologia ja potilaiden mieltymykset parhaan hoitovaihtoehdon ohjaamiseksi.
Todisteet ja teknologia kehittyvät nopeasti, ja niiden myötä jokainen ihminen voi saada biologisesti paremmin räätälöityä hoitoa. Koulutettujen tiimien, selkeiden ohjeiden ja integroidun datan avulla... täsmälääkemääräys ei ole enää poikkeus tulla yleiseksi käytännöksi.
Olen teknologian harrastaja, joka on muuttanut "nörtti"-harrastuksensa ammatiksi. Olen käyttänyt yli 10 vuotta elämästäni uusinta teknologiaa käyttäen ja kaikenlaisten ohjelmien parissa puhtaasta uteliaisuudesta. Nyt olen erikoistunut tietotekniikkaan ja videopeleihin. Tämä johtuu siitä, että yli 5 vuoden ajan olen työskennellyt kirjoittaen useille teknologiaa ja videopelejä käsitteleville verkkosivustoille ja luonut artikkeleita, jotka pyrkivät antamaan sinulle tarvitsemaasi tietoa kielellä, jota kaikki ymmärtävät.
Jos sinulla on kysyttävää, tietoni ulottuu kaikesta Windows-käyttöjärjestelmään liittyvästä sekä matkapuhelimien Androidista. Ja sitoumukseni on sinulle, olen aina valmis käyttämään muutaman minuutin ja auttamaan sinua ratkaisemaan kaikki kysymyksesi, joita sinulla saattaa olla tässä Internet-maailmassa.