- La farmacogenómica adapta fármacos y dosis al perfil genético para mejorar eficacia y seguridad.
- Genes de metabolismo (CYP), dianas y transportadores condicionan el fenotipo y la respuesta.
- Pruebas (paneles/WES), guías clínicas y HCE con alertas hacen accionables los resultados.
- Clopidogrel–CYP2C19, DPYD–fluoropirimidinas y SLCO1B1–simvastatina son ejemplos clave.
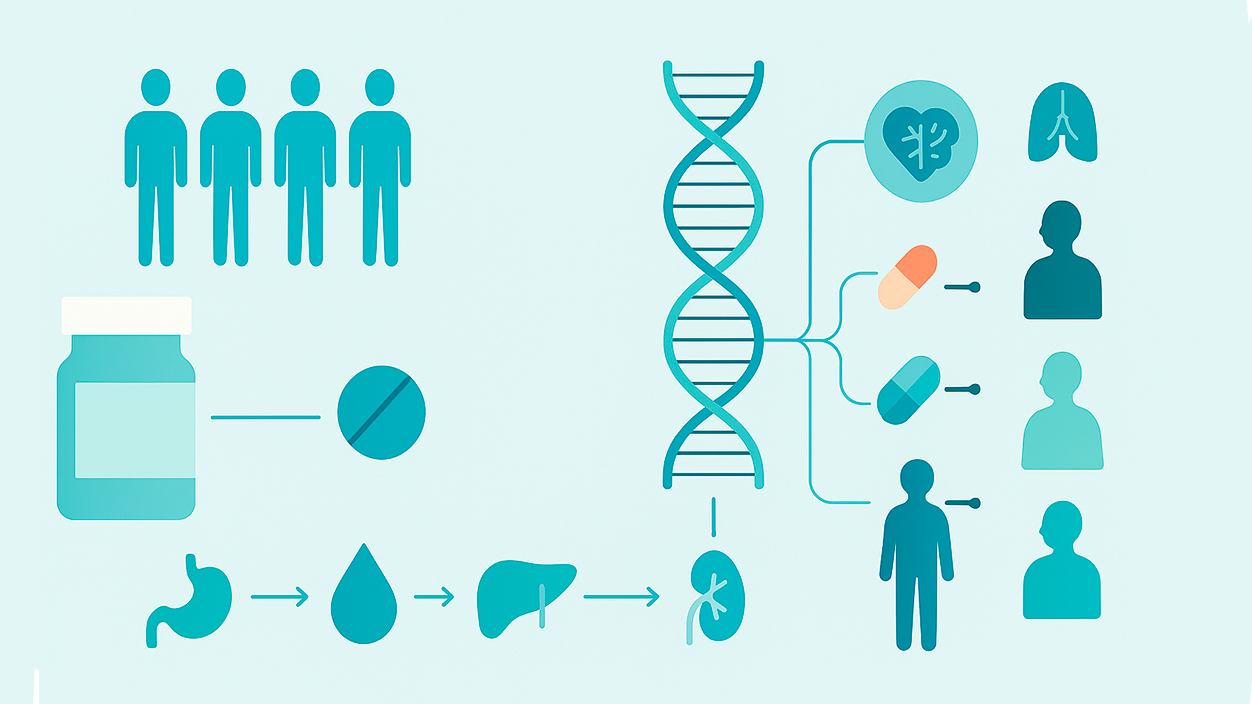
En los últimos años, la medicina ha pasado de un enfoque de talla única a otro decididamente personalizado, y la farmacogenómica es una de las razones. Esta disciplina estudia cómo nuestras variantes genéticas influyen en la respuesta a los medicamentos, con el objetivo de prescribir el fármaco adecuado, a la dosis adecuada y en el momento oportuno.
Este cambio de paradigma permite abandonar el ensayo y error en la prescripción y reducir reacciones adversas. No es baladí: las reacciones adversas a medicamentos suponen un problema de salud pública y una causa relevante de hospitalizaciones y mortalidad. La farmacogenómica ofrece herramientas para anticipar la eficacia y seguridad de un tratamiento antes de iniciarlo.
Qué es la farmacogenómica y por qué importa

La farmacogenómica combina la farmacología (estudio de los fármacos) y la genómica (estudio de los genes y su función) para comprender cómo ciertas variantes del ADN y su expresión modifican la respuesta a los tratamientos. Gracias a ello, se pueden ajustar medicamentos y dosis en función del perfil genético de cada paciente.
En la práctica, esto implica pasar del «mismo fármaco para todos» a un enfoque de precisión. Muchos medicamentos no funcionan igual en todas las personas y algunos pueden causar toxicidades graves en quienes portan variantes concretas. Con información genética, el clínico puede reducir riesgos y mejorar resultados.
De la medicina de talla única a la medicina personalizada

La medicina moderna persigue «el fármaco correcto, en la dosis correcta, en el momento correcto». Para lograrlo, hay que considerar la enorme variabilidad interindividual. La respuesta a fármacos depende de factores genéticos, epigenéticos y ambientales, y la contribución de cada uno varía según el medicamento.
Un ejemplo paradigmático es la warfarina: su dosis óptima está condicionada por genética (CYP2C9, VKORC1) y por variables no genéticas como edad, sexo, peso, tabaquismo o interacciones. Integrar todos estos parámetros mejora la predicción de dosis y reduce eventos adversos.
Hoy sabemos que más del 90% de la población porta al menos una variante farmacogenética potencialmente accionable, y que hay cientos de fármacos con consideraciones farmacogenómicas reconocidas por autoridades regulatorias. Esto refuerza la utilidad clínica de incorporar la genética a la prescripción.
Mirando al futuro, la farmacogenómica será clave para personalizar terapias en ámbitos como cardiología, oncología, neurología o neumología, y acelerar el desarrollo de nuevos fármacos más seguros y eficaces.
Genes, biomarcadores y vías que determinan la respuesta

La variabilidad genética suele medirse mediante biomarcadores como polimorfismos de un solo nucleótido (SNP). Estas variantes pueden alterar enzimas metabolizadoras, receptores o transportadores, y con ello modificar la eficacia o la seguridad de un fármaco.
En el metabolismo (fase I), la familia de enzimas CYP450 descompone gran número de medicamentos. Su nomenclatura obedece a familia, subfamilia y enzima (p. ej., CYP2E1), y las variantes alélicas se anotan con sistema de «estrellas» (*1, *2, *3…). Cambios en estos genes generan fenotipos de metabolización que condicionan niveles plasmáticos y respuesta clínica.
En fase II, destacan glutatión S-transferasas, N-acetiltransferasas, UGT, sulfotransferasas y metiltransferasas como TPMT o COMT. Variantes en estas enzimas se asocian con toxicidades específicas. Si la eliminación se enlentece por genética, un fármaco con estrecho rango terapéutico puede alcanzar concentraciones peligrosas.
Las dianas farmacológicas también importan: polimorfismos en genes que codifican receptores alteran su función o expresión y cambian sensibilidad o riesgo de efectos adversos. Del mismo modo, transportadores ABC como P-gp (ABCB1/MDR1) modifican absorción, distribución y eliminación, afectando exposición tisular y respuesta.
En suma, la respuesta a fármacos se explica por la interacción entre farmacocinética (ADME) y farmacodinámica, ambas moduladas por la genética del paciente y, en ocasiones, por el propio genoma del tumor en oncología.
Fenotipos de metabolización: del ultrarrápido al lento

Según la actividad enzimática agregada, un individuo puede clasificarse como metabolizador ultrarrápido, rápido, normal, intermedio o lento. Esta etiqueta no es «buena o mala» per se: su relevancia depende del fármaco y de si éste es activo o profármaco.
Si una persona es metabolizadora lenta de una vía que inactiva el fármaco, podría acumular niveles altos y presentar toxicidad. Por el contrario, si esa misma vía activa un profármaco, un metabolizador lento tendrá menos principio activo y fallo terapéutico. Por eso las guías clínicas ajustan recomendaciones según fármaco y fenotipo.
- Ultrarrápido: convierte el fármaco o lo elimina con mucha rapidez; puede requerir dosis mayores o alternativas si hay pérdida de eficacia.
- Intermedio/lento: mayor exposición a fármacos activos; riesgo de eventos adversos y necesidad de reducir dosis o evitar el fármaco.
- Normal: actividad enzimática esperada; suele seguirse dosis estándar, vigilando factores no genéticos.
Además del ADN, la respuesta final está modulada por edad, sexo, peso, dieta, comorbilidades y polifarmacia, que pueden inducir o inhibir vías metabólicas y alterar la concentración de los fármacos.
Cómo investigamos: genes candidatos, GWAS y paneles
Existen dos estrategias clásicas para descubrir asociaciones gen–fármaco. La primera son los estudios de genes candidatos, centrados en genes de metabolismo, transporte o diana, más económicos y directos para validar relaciones genotipo–fenotipo.
La segunda, los GWAS (estudios de asociación de todo el genoma), comparan perfiles genéticos entre grupos (casos y controles) y señalan variantes asociadas a respuesta, eficacia o toxicidad. Con la caída de costes de secuenciación, estos estudios han impulsado hallazgos en múltiples áreas terapéuticas.
En el laboratorio clínico, la secuenciación del genoma completo (WGS) es el ideal técnico, pero por coste hoy se emplean sobre todo exoma (WES) y paneles dirigidos. Un panel óptimo incluye marcadores farmacocinéticos y farmacodinámicos, variantes con evidencia funcional y una frecuencia poblacional útil para los fármacos de uso común.
Para estandarizar la práctica, existen guías y bases de conocimiento que recogen evidencia clínica y recomendaciones de dosificación o selección de alternativas según el genotipo. Estas guías facilitan que los resultados de las pruebas se traduzcan en decisiones terapéuticas accionables.
Ejemplos clínicos donde la genética marca la diferencia
Algunos escenarios están firmemente establecidos. Por ejemplo, el clopidogrel es un profármaco cuya bioactivación depende de CYP2C19. Variantes de pérdida de función se asocian con menor generación de metabolito activo y más fallos terapéuticos; en estos casos se recomienda cambiar a otra antiagregación.
Las fluoropirimidinas (5-FU, capecitabina) se ven afectadas por variantes en DPYD: una actividad enzimática reducida aumenta el riesgo de toxicidad severa, motivo por el que muchas guías proponen ajustes de dosis o alternativas en portadores de alelos de riesgo.
Con opioides, la variabilidad en vías CYP puede alterar la generación de metabolitos activos e incrementar el riesgo de depresión respiratoria si el metabolismo es inusualmente alto o bajo según el fármaco. Esto ilustra cómo el fenotipo de metabolización cambia el balance beneficio–riesgo.
Otro caso es la miopatía con simvastatina: variantes en transportadores hepáticos (p. ej., SLCO1B1) reducen la captación y elevan su concentración plasmática, lo que se ha vinculado a daño muscular y requiere precaución en la elección o dosificación.
También se conocen asociaciones entre ciertos HLA y reacciones cutáneas graves como el síndrome de Stevens–Johnson o la necrólisis epidérmica tóxica, y predisposición a hipertermia maligna con agentes anestésicos en contextos genéticos específicos.
Pruebas farmacogenómicas: qué analizan y cómo se realizan

Una prueba puede hacerse con saliva, frotis bucal o sangre. El laboratorio extrae ADN y analiza variantes con impacto en fármacos cubiertos por guías clínicas. Los resultados no cambian a lo largo de la vida (tu genotipo permanece), aunque las interpretaciones se actualizan conforme avanza la evidencia.
En la práctica clínica, los informes indican genes, genotipos, fenotipos (p. ej., metabolizador intermedio) y recomendaciones: ajustar dosis, elegir alternativa o mantener el fármaco con vigilancia. Es vital que la modificación del tratamiento la haga siempre un profesional sanitario.
Algunos laboratorios ofrecen paneles amplios para pacientes en polifarmacia. Esta aproximación preventiva permite evitar prescripciones de riesgo desde el inicio del tratamiento, en lugar de reaccionar tras un evento adverso.
Limitaciones y retos que aún debemos superar
Persisten barreras: falta de laboratorios coste-efectivos, estándares de calidad bien definidos, guías y garantías legales/éticas, así como una brecha de profesionales capacitados para interpretar resultados.
Otra limitación frecuente es el tiempo de respuesta: si las pruebas se hacen tras un evento adverso, pierden parte de su valor preventivo. De ahí el impulso a los modelos preemptivos (genotipado preventivo) integrados en historia clínica y sistemas de apoyo a la decisión.
Los volúmenes de datos también son un desafío: integrar, interpretar y almacenar información genómica de forma segura y con bajo coste requiere inversión en infraestructura y gobernanza de datos.
Por último, hace falta más formación clínica y herramientas de uso sencillo. La evidencia se acumula rápidamente, pero convertirla en decisiones claras en consulta es el eslabón crítico para que la farmacogenómica sea rutina.
Farmacogenómica vs farmacogenética: no es lo mismo
La farmacogenética se refiere a cómo variaciones en genes concretos afectan el metabolismo y la respuesta a un fármaco. La farmacogenómica amplía el foco a todo el genoma y, además de cambios en ADN, incorpora aspectos de expresión génica que modulan la respuesta farmacológica.
En la literatura, ambos términos se usaron de forma intercambiable durante años, pero el auge de la genómica ha consolidado una distinción más precisa: farmacogenética es una parte de la farmacogenómica, no su sinónimo.
Cuándo solicitar una prueba farmacogenómica
Resulta especialmente útil antes de iniciar fármacos con alto riesgo de toxicidad ligada a variantes conocidas (p. ej., tiopurinas y TPMT/NUDT15; fluoropirimidinas y DPYD; carbamazepina y HLA), en fallos terapéuticos inexplicables o cuando se planifica polifarmacia.
También es razonable en pacientes en los que se anticipan múltiples exposiciones a medicamentos a lo largo del tiempo: un resultado genético sirve de por vida y puede consultarse cada vez que se prescribe.
Para maximizar su valor, los resultados deben estar integrados en la historia clínica electrónica con alertas y reglas de decisión, y acompañarse de formación al equipo asistencial.
La farmacogenómica, bien implantada, actúa como una capa de seguridad adicional que se suma al juicio clínico, la farmacología clásica y las preferencias del paciente para guiar la mejor opción terapéutica.
La evidencia y la tecnología avanzan rápido, y con ellas la posibilidad de que cada persona reciba un tratamiento más ajustado a su biología. Con equipos formados, guías claras y datos integrados, la prescripción de precisión dejará de ser la excepción para convertirse en práctica habitual.
Soy un apasionado de la tecnología que ha convertido sus intereses «frikis» en profesión. Llevo más de 10 años de mi vida utilizando tecnología de vanguardia y trasteando todo tipo de programas por pura curiosidad. Ahora me he especializado en tecnología de ordenador y videojuegos. Esto es por que desde hace más de 5 años que trabajo redactando para varias webs en materia de tecnología y videojuegos, creando artículos que buscan darte la información que necesitas con un lenguaje entendible por todos.
Si tienes cualquier pregunta, mis conocimientos van desde todo lo relacionado con el sistema operativo Windows así como Android para móviles. Y es que mi compromiso es contigo, siempre estoy dispuesto a dedicarte unos minutos y ayudarte a resolver cualquier duda que tengas en este mundo de internet.